생물학개론 - 생명체의 구성성분 : 원자에서 분자까지 Of atoms and molecules




















생명체의 구성성분
– 원자에서 분자까지
Of atoms and molecules
생물학개론
A. Matter (물질)
Material that takes up space.
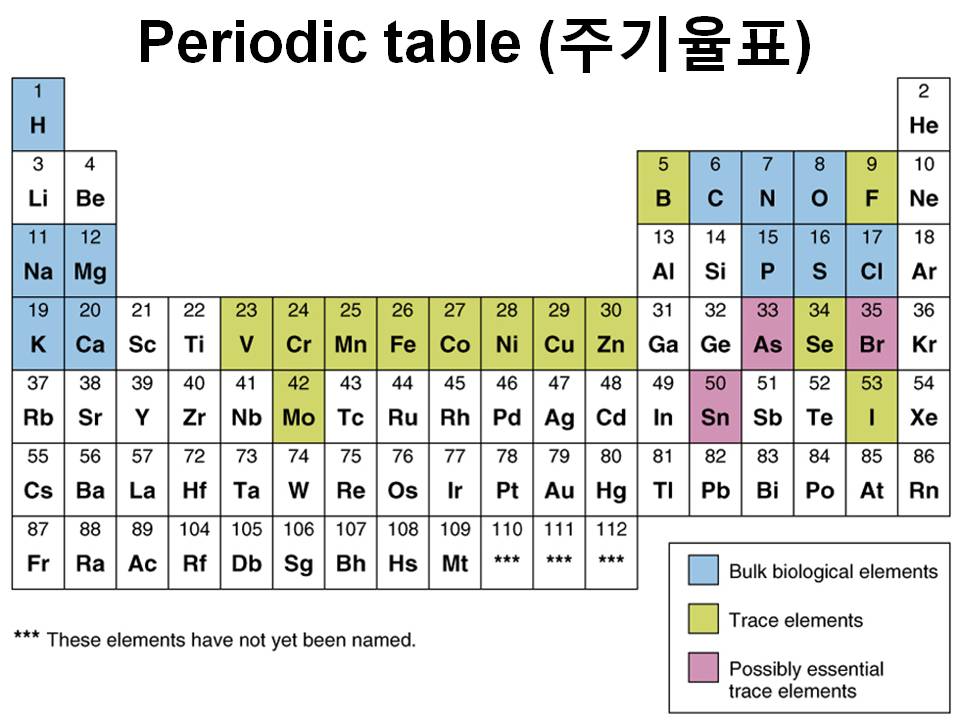
1. Elements (원소)
원자를 구성하는 순수한 화학물질
Pure chemical substances composed of atoms.
• 산소 Oxygen (O), 나트륨 sodium(Na), 구리 copper(Cu), 칼륨 potassium (K) 등
• How many elements exist?
• 118 elements have thus far been named (92 are naturally occurring; 26 are synthetic).
총 118개 원소 중 92개의 자연원소, 26개의 합성원소
• How many of these elements are essential to life? 25 elements are essential to life
25개의 원소가 필수원소: 탄소(C), 수소(H), 산소(O), 질소(N), 황(S), 인(P) 등
• The essential elements are divided into:
• Bulk elements (다량원소): needed in relatively large amounts
• Examples: C, O, H, N
• Trace elements (미량원소): needed in relatively small amounts 생명체를 유지하는데 필요한 화학반응을 신속하게 일어나도록 도와줌
• Examples: Fe, K, Na, Zn, Ca
2. Atom
원소의 성질을 가지고 있는 가장 작은 성분 The smallest “piece” of an element that retains the characteristics of that element.
핵(nucleus)과 전자(electrons)로 구성
핵 : 양성자(protons)+ 중성자(neutrons)
핵을 둘러싸는 전자
Atomic number (원자번호)
• 원자의 양성자수 – 원자의 실체
# protons in nucleus of an atom (establishes identity of the atom)
• 대부분의 원자는 전기적으로 중성이며, 원자번호가 전자수 Since most atoms are electrically neutral, atomic number indicates # of electrons as well.
Atomic mass (원자량)- 질량수
• 원자핵의 양성자와 중성자의 합 # protons plus # neutrons in nucleus of an atom
Isotopes (동위원소)
• 양성자수는 같지만 중성자의 수가 다른 원자 Atoms having the same number of protons, but differing numbers of neutrons.
• If an isotope is unstable, it is termed radioactive (방사선 동위원소)
• 자연계에는 각각 다른 질량을 가진 원자들이 존재
• 주기율표의 원자 질량은 각각의 질량을 가진 원자들의 자연 발생량을 따져서 계산해놓은 것
• 양성자 수 = 중성자 수일 경우엔 안정
• 수가 다를 경우엔 불안정하여 동위원소가 붕괴하며 방사선 방출
3. Compound
두 개 이상의 원소들로 연결된 물질
A pure substance formed when atoms of different elements bond.
분자: 두 개 또는 그 이상의 원소들로 연결된 원자들이 만드는 하나의 화합물
The number of atoms of each element is written as a subscript. 각 원자수는 아래첨자로
Examples:
• CO2 carbon dioxide
• H2O water
• CH4 methane
• C6H12O6 glucose
4. Molecule
화합물의 가장작은 단위
Smallest piece of a compound that retains characteristics of that compound.
The number of molecules is written as a coefficient. 분자의 수는 계수로 표현
Examples:
• 4CO2 4 molecules of carbon dioxide
• 2C6H12O6 2 molecules of glucose
• 6O2 6 molecules of oxygen
Chemical Reactions (화학반응)
두 개 또는 그 이상의 분자들이 서로 반응하여 다른 분자를 만든다.
• 반응물질은 왼쪽 The reactants of a reaction are written to the left of the arrow.
• 생성물질은 오른쪽 The products of a reaction are written to the right of the arrow.
Example:
6O2 + C6H12O6 6H2O + 6CO2 + energy
5. Chemical Bonds
각 원자는 화학결합을 통해 분자를 형성.
전자의 수는 화학 반응성을 결정한다.
• 화학결합은 원자의 최외각 전자수로 결정
Type of bond formed is determined by the number of valence electrons in the interacting atoms [octet rule]. (옥텟법칙)
• 화학결합은 모든 원자의 최외각 전자를 채우거나 제거하여 안정한 8개의 전자를 채우는데 있음
The goal of chemical bonding is for all atoms involved to complete or eliminate their outer electron shells.
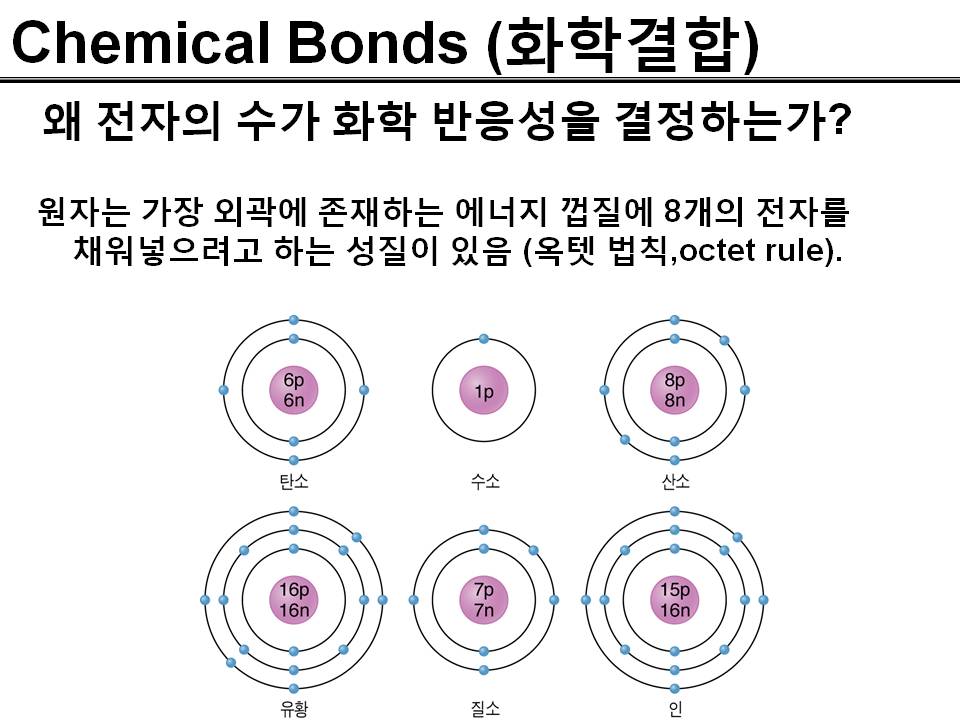
왜 전자의 수가 화학 반응성을 결정하는가?
원자는 가장 외곽에 존재하는 에너지 껍질에 8개의 전자를 채워넣으려고 하는 성질이 있음 (옥텟 법칙,octet rule).
전자가 화학 반응성을 결정
화학 결합의 종류:
공유결합 (전자공유, Covalent bond)
이온결합 (ionic bond)
약한 화학 결합
- 수소결합(hydrogen bond)
- 반데르발스 인력(van der Waals attraction) a)
Covalent bonds (공유결합) - 전자를 공유
• 강한 화학결합
• 원자가 전자 3~4 개)
• 공유하는 두 원자의 전자쌍의 수가 단일, 이중, 삼중결합 결정
• 비극성 & 극성
• 비극성 공유결합 - 원자들 사이의 전자들이 동등하게 공유 Ex. Methane
• 극성공유결합 - 전자들이 다른 원자핵보다 다른 원자핵에 더 많이 끌려가는 경우, 전기음성도 차이 Ex. water
Ionic bonds (이온결합) - form when oppositely charged ions are attracted to each other. 서로 상반된 전하를 띤 이온간의 결합
• 공유결합보다 약하다
• 주로 전자가 6,7개나 1,2개를 가진 원자 사이에서의 결합
• 한 원자의 전기음성도가 매우 크면 원자는 다른 원자로부터 전자를 받음. 이때 두 원자는 서로 상반된 전하를 띠고 끌어당기는데 이러한 인력에 의한 결합.
• 물에서는 매우 약한 결합. 녹아서 이온을 만든다
Ex. NaCl
약한 화학결합: 두 분자의 상반된 전하들끼리 서로 끌어당긴다.
수소결합: 극성 공유 결합을 하는 분자들 가운데 수소를 포함한 두 분자들 사이의 결합
• Hydrogen bonds (수소결합) - form when opposite charges on two molecules are attracted to each other. 두 상반된 전하를 가진 두 분자 사이에서의 인력
• weakest type of bond*
Ex. DNA, H2O
6. Attractive forces
• van der Waals attraction 반데르발스 인력
• 전기적으로 중성인 분자 사이 또는 분자 내에서 일시적으로 전하를 띠며 일어나는 역동적인 인력
• Attraction between molecules or within molecules that occur when oppositely charged regions approach each other 분자들 간의 서로 상반된 전하를 띤 부분이 접근할 때의 인력
• Often used to shape molecules 고분자의 구조 형성
• Interactions with water 물과의 상호작용
Hydrophobic (소수성): 물에 의해 반발하는 전하를 띠지 않는 물질의 부분
parts of a molecule that do not have charges cannot interact with water
Hydrophilic (친수성): 물에 끌리는 전하를 가진 물질의 부분
parts of a molecule that have charges can interact with water
B. The Importance of Water
1. Properties 성질
• 물: 2개 수소원자 1개의 산소원자
• 응집력: 물 분자 사이의 지속적인 재결합.
• 부착: 물과 다른 물질과의 수소결합.
• 침윤, 팽윤: 물을 흡수하여 팽창
• 높은 열용량: 물의 온도를 올리는데 많은 열 필요
• 높은 기화열: 물을 증발시키는 데 많은 열 필요
• 고체(얼음)가 액체보다 밀도가 낮다
2. Solutions (용액)
• 용매: 용질을 용해시키는 화합물.
• 용액: 용매에 녹아있는 하나 또는 그 이상의 화합물.
If solvent is water, then it is an aqueous solution. 용매가 물이면, 수용액
Water is a strong solvent because it separates charged atoms or molecules. 물은 전하를 띠고 있는 물질에 강한 용매
3. Acids & Bases
• Acids 산 - 용액에 수소이온을 증가
substances that add H+ to a solution.
• Bases 염기 - 용액에 수소이온을 감소
substances that remove H+ from solution.
• 산/ 염기: H+ /OH-
• pH 7: 한 개의 H+ 에 대해 한 개의 OH- 가 존재.
• pH 3: 10,000개의 H+ 에 대해 한 개의 OH- 가 존재.
• Buffer systems 완충계: 산 또는 염기를 첨가했을 때 pH의 급격한 변화를 적게 하는 용액.
• 주로 약산이나 약염기
